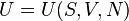- la energía cinética interna, es decir, de las sumas de las energías cinéticas de las individualidades que lo forman respecto al centro de masas del sistema,
- la energía potencial interna, que es la energía potencial asociada a las interacciones entre estas individualidades.1
- En un gas ideal monoatómico bastará con considerar la energía cinética de traslación de sus átomos.
- En un gas ideal poliatómico, deberemos considerar además la energía vibracional y rotacional de las mismas.
- En un líquido o sólido deberemos añadir la energía potencial que representa las interacciones moleculares.
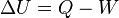 (En termodinámica se considera el trabajo negativo cuando este entra en el sistema termodinámico, positivo cuando sale). Aunque el calor transmitido depende del proceso en cuestión, la variación de energía interna es independiente del proceso, sólo depende del estado inicial y final, por lo que se dice que es una función de estado. Del mismo modo
(En termodinámica se considera el trabajo negativo cuando este entra en el sistema termodinámico, positivo cuando sale). Aunque el calor transmitido depende del proceso en cuestión, la variación de energía interna es independiente del proceso, sólo depende del estado inicial y final, por lo que se dice que es una función de estado. Del mismo modo 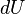 es una diferencial exacta, a diferencia de
es una diferencial exacta, a diferencia de  , que depende del proceso.
, que depende del proceso.Si calculamos su diferencial:
se definen sus derivadas parciales:
- la temperatura

- la presión
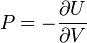
- el potencial químico
 .
.
Como T, P y
 son derivadas parciales de U, serán funciones de las mismas variables que U:
son derivadas parciales de U, serán funciones de las mismas variables que U:Variación sin cambio de estado[editar]
 = temperatura final del sistema - temperatura inicial (K).
= temperatura final del sistema - temperatura inicial (K).Ejemplo[editar]
 y reemplazando los valores, tenemos;
y reemplazando los valores, tenemos;- Q = 1 [cal/g·°C] · 1 [g] · (15 - 14) [°C] = 1 [cal]
Energía cinética media de un gas ideal[editar]

 =Velocidad media de la molécula
=Velocidad media de la molécula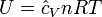
Máquina térmica
Una máquina térmica es un conjunto de elementos mecánicos que permite intercambiar energía, generalmente a través de un eje, mediante la variación de energía de un fluido que varía su densidad significativamente al atravesar la máquina. Se trata de una máquina de fluido en la que varía el volumen específico del fluido en tal magnitud que los efectos mecánicos y los efectos térmicos son interdependientes.Por el contrario, en una máquina hidráulica, que es otro tipo de máquina de fluido, la variación de densidad es suficientemente pequeña como para poder desacoplar el análisis de los efectos mecánicos y el análisis de los efectos térmicos, llegando a despreciar los efectos térmicos en gran parte de los casos. Tal es el caso de una bomba hidráulica, a través de la cual pasa líquido. Alejándose de lo que indica la etimología de la palabra «hidráulica», también puede considerarse como máquina hidráulica un ventilador, pues, aunque el aire es un fluido compresible, la variación de volumen específico no es muy significativa con el propósito de que no se desprenda la capa límite.En una máquina térmica, la compresibilidad del fluido no es despreciable y es necesario considerar su influencia en la transformación de energía.Máquina térmica y motor térmico[editar]
En un principio se podría definir a una máquina térmica como un dispositivo, equipo o una instalación destinada a la producción de trabajo en virtud de un aporte calórico. Aunque en algunas definiciones se identifican como sinónimos los términos «máquina térmica motora» y «motor térmico», en otras se diferencian ambos conceptos. Al diferenciarlos, se considera que un motor térmico es un conjunto de elementos mecánicos que permite obtener energía mecánica a partir de la energía térmica obtenida mediante una reacciónde combustión o una reacción nuclear. Un motor térmico dispone de lo necesario para obtener energía térmica, mientras que una máquina térmica motora necesita energía térmica para funcionar, mediante un fluido que dispone de más energía a la entrada que a la salida.1Clasificación[editar]
Según el sentido de transferencia de energía[editar]
Las máquinas térmicas pueden clasificarse, según el sentido de transferencia de energía, en:- Máquinas térmicas motoras, en las cuales la energía del fluido disminuye al atravesar la máquina, obteniéndose energía mecánica en el eje.
- Máquinas térmicas generadoras, en las cuales la energía del fluido aumenta al atravesar la máquina, precisándose energía mecánica en el eje.
Según el principio de funcionamiento[editar]
Atendiendo al principio de funcionamiento, las máquinas térmicas se clasifican en:- Máquinas volumétricas o máquinas de desplazamiento positivo, cuyo funcionamiento está basado en principios mecánicos ehidrostáticos, de manera que el fluido en algún instante está contenido en un volumen limitado por los elementos de la máquina. En este tipo de máquinas el flujo es pulsatorio. Se dividen a su vez en dos tipos según el movimiento del órgano propulsor: alternativas, cuyo movimiento es rectilíneo; y rotativas, cuyo movimiento es circular.
- Turbomáquinas, cuyo funcionamiento está basado en el intercambio de cantidad de movimiento entre el fluido y un rodete. En estas máquinas el flujo es continuo.
Teniendo en cuenta lo anterior, podemos clasificar las máquinas térmicas tal como se recoge en el cuadro siguiente.Máquinas térmicas Motoras Volumétricas Alternativas Máquina de vapor Rotativas Motor Wankel Turbomáquinas Turbina Generadoras Volumétricas Alternativas Compresor de émbolo Rotativas Compresor rotativo Turbomáquinas Turbocompresor Balance de energía en una máquina térmica[editar]
Un sistema abierto es aquel que intercambia materia y energía con el entorno. Aplicando el primer principio de la termodinámica para unsistema abierto, el incremento de energía del sistema en un intervalo de tiempo es: donde;
donde;- Q es el calor entregado al sistema. Será negativo cuando el calor sea entregado por el sistema.
- W es el trabajo entregado al sistema, en forma de trabajo mecánico y energía de presión. Será negativo cuando el calor sea entregado por el sistema.
- El subíndice in representa la materia que entra al sistema.
- El subíndice out representa la materia que sale del sistema.
- h es la entalpía por unidad de masa del flujo
- V2/2 es la energía cinética por unidad de masa del flujo.
- gz es la energía potencial por unidad de masa del flujo
Haciendo la derivada de la expresión anterior respecto al tiempo, se obtiene: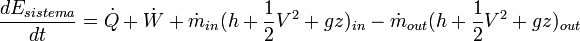 Debe tenerse en cuenta que en máquinas generadoras, puede aparecer esta expresión con el signo de W cambiado, para que se exprese el trabajo entregado por la máquina y así W sea positivo.Véase también: Criterio de signos termodinámico
Debe tenerse en cuenta que en máquinas generadoras, puede aparecer esta expresión con el signo de W cambiado, para que se exprese el trabajo entregado por la máquina y así W sea positivo.Véase también: Criterio de signos termodinámicoSimplificaciones[editar]
La ecuación que expresa el balance de energía puede simplificarse en los siguientes casos:- Sistema en reposo
Cuando el sistema está en reposo, tal como en máquinas estacionarias, las variaciones de energía potencial y energía cinética serán nulas.
- Régimen permanente
Cuando la máquina funciona en régimen permanente, las cantidades de masa y energía que entran son iguales a las que salen, pues de lo contrario variarían esa cantidades dentro del sistema.

- Variación de energía potencial despreciable
En la mayoría de las máquinas térmicas, diferencia de energía potencial del flujo que sale respecto al que entra es poco significativo en comparación con los otros términos asociados a la energía del flujo.
- Sistemas adiabáticos
En la mayoría de las máquinas térmicas, la transferencia de calor es despreciable frente a otros intercambios de energía. Teniendo en cuenta la transmisión de calor porconducción y convección:donde Q es el calor intercambiado, U es el coeficiente global de transferencia de calor, A es la superficie del sistema y es la diferencia de temperaturas media logarítmica, puede considerarse que el sistema es adiabático cuando se da alguna de las siguientes condiciones:
es la diferencia de temperaturas media logarítmica, puede considerarse que el sistema es adiabático cuando se da alguna de las siguientes condiciones:- La superficie externa del sistema está bien aislada térmicamente.
- La superficie externa del sistema es muy pequeña.
- La diferencia de temperaturas entre el flujo y el entorno del sistema es pequeña.
- El fluido pasa a través de la máquina tan rápido que apenas hay tiempo para que sea significativa la transferencia de calor por unidad de masa.
Máquina térmica en régimen permanente con variación de energía potencial despreciable[editar]
En una máquina térmica que funciona en régimen permanente en la cual se desprecie la variación de energía potencial, la expresión el primer principio de la termodinámica puede expresarse como![\dot W = \dot m [(h + \frac{V^{2}}{2})_{out} - (h + \frac{V^{2}}{2})_{in}] = \dot m [ h_{0 out} - h_{0 in} ]](https://upload.wikimedia.org/math/0/4/b/04ba969e4508721476a6c9dd9a6e36c2.png) donde h0 es la entalpía de parada.En los ciclos termodinámicos asociados a la turbina de vapor, la energía cinética específica puede considerarse despreciable frente a la entalpía, resultando
donde h0 es la entalpía de parada.En los ciclos termodinámicos asociados a la turbina de vapor, la energía cinética específica puede considerarse despreciable frente a la entalpía, resultando![\dot W = \dot m [(h + \frac{V^{2}}{2})_{out} - (h + \frac{V^{2}}{2})_{in}] = \dot m [ h_{0 out} - h_{0 in} ]](https://upload.wikimedia.org/math/0/4/b/04ba969e4508721476a6c9dd9a6e36c2.png)